Plateforme iPSC Nantes - Cellules souches pluripotentes induites - test 2
La plateforme
La plateforme iPSC est experte dans la culture de cellules souches pluripotentes humaines. Elle est notamment dédiée à la reprogrammation de cellules adultes en cellules souches pluripotentes induites (iPSC), ainsi qu’à l’édition du génome de ces cellules ou de lignées iPSC témoins.
Les cellules iPSC présentent la capacité unique de se différencier en n’importe quel type cellulaire de l’organisme adulte. Cette propriété en fait un outil de choix pour la médecine régénérative, le développement de nouveaux traitements, la recherche pharmaceutique, ainsi que pour l’étude des mécanismes des maladies génétiques.
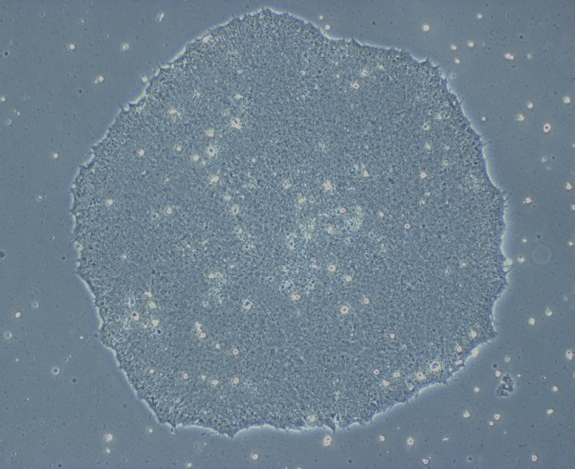
iPSC ©plateforme iPSC
Créée en 2012, la Plateforme iPSC a produit plus de 250 lignées d'iPSC à destination de 80 équipes de recherche.
Depuis l’ouverture de l’édition du génome en 2024, 5 lignées d'iPSC ont pu être éditées.
En partenariat avec le CHU de Nantes, la plateforme iPSC a développé, caractérisé et mis à disposition de la communauté scientifique une lignée de cellules souches embryonnaires humaines (hESC).
Intégrée aux réseaux européens (CoReuStem) et internationaux (Coredinates) des plateformes de cellules souches pluripotentes, la plateforme iPSC partage son expertise à travers des formations proposées en local et au national
Nos expertises
- Cellules primaires reprogrammables : Fibroblastes, PBMC, cellules amniotiques, cellules urinaires
- Utilisation de techniques non-intégratives : Sendaï virus ou mRNA
- Contrôles qualité réalisés sur les lignées : qPCR des gènes de pluripotence, contrôle absence du transgène SeV (le cas échéant), vérification de l'intégrité génomique, validation de la capacité des cellules à se différencier, absence mycoplasmes

Reprogrammation ©NU
La plateforme conseille également les équipes dans la gestion de leurs propres banques cellulaires, en particulier pour la mise en place de Master et Working Cell Banks.
- à Nantes, dans le cadre de l'infrastructure ION
- dans le Grand Ouest, via le projet fédérateur OuestOÏD

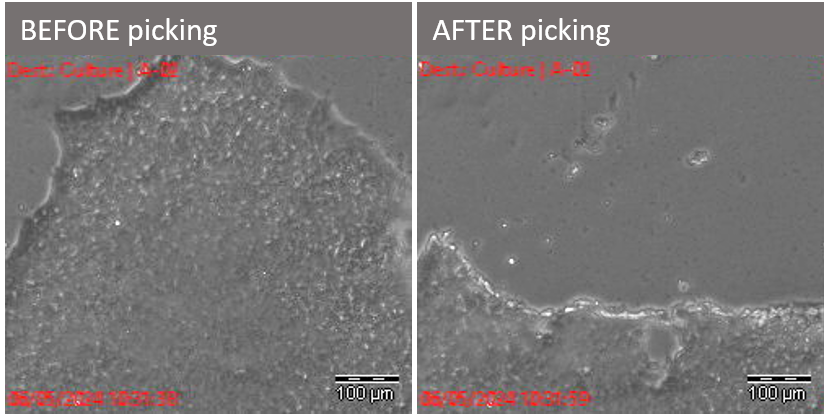
iPSC piquées au Cell Celector ©plateforme iPSC
Cette formation a pour objectif d’apporter les bases théoriques (9H de cours) et pratiques (13H de Travaux Pratiques) sur la culture des cellules souches pluripotentes.
Chaque stagiaire bénéficie d’un accompagnement personnalisé pour la mise en place de cette culture dans son laboratoire ainsi que pour le développement de son projet de recherche.
Publications marquantes
- Martin L, Maric D, Idriss S, et al. Identification of Hepatic-like EPO as a Cause of Polycythemia. N Engl J Med. 2025;392(17):1684-1697. doi:10.1056/NEJMoa241495
- Geryk M, Canac R, Forest V, et al. Generation of a patient-specific induced pluripotent stem cell line carrying the DES p.R406W mutation, an isogenic control and a DES p.R406W knock-in line. Stem Cell Res. 2024;77:103396. doi:10.1016/j.scr.2024.103396
- Warin J, Vedrenne N, Tam V, et al. In vitro and in vivo models define a molecular signature reference for human embryonic notochordal cells. iScience. 2024;27(2):109018. Published 2024 Jan 26. doi:10.1016/j.isci.2024.109018
- Delamare M, Le Roy A, Pacault M, et al. Characterization of genetic variants in the EGLN1/PHD2 gene identified in a European collection of patients with erythrocytosis. Haematologica. 2023;108(11):3068-3085. Published 2023 Nov 1. doi:10.3324/haematol.2023.282913
- Girardeau A, Atticus D, Canac R, et al. Generation of human induced pluripotent stem cell lines from four unrelated healthy control donors carrying European genetic background. Stem Cell Res. 2022;59:102647. doi:10.1016/j.scr.2021.102647
- Al Sayed ZR, Jouni M, Gourraud JB, et al. A consistent arrhythmogenic trait in Brugada syndrome cellular phenotype. Clin Transl Med. 2021;11(6):e413. doi:10.1002/ctm2.413
- Castel G, Meistermann D, Bretin B, et al. Induction of Human Trophoblast Stem Cells from Somatic Cells and Pluripotent Stem Cells. Cell Rep. 2020;33(8):108419. doi:10.1016/j.celrep.2020.108419
- Al Sayed ZR, Canac R, Cimarosti B, et al. Human model of IRX5 mutations reveals key role for this transcription factor in ventricular conduction. Cardiovasc Res. 2021;117(9):2092-2107. doi:10.1093/cvr/cvaa259
- Montibus B, Cercy J, Bouschet T, et al. TET3 controls the expression of the H3K27me3 demethylase Kdm6b during neural commitment. Cell Mol Life Sci. 2021;78(2):757-768. doi:10.1007/s00018-020-03541-8
- Colombier P, Halgand B, Chédeville C, et al. NOTO Transcription Factor Directs Human Induced Pluripotent Stem Cell-Derived Mesendoderm Progenitors to a Notochordal Fate. Cells. 2020;9(2):509. Published 2020 Feb 24. doi:10.3390/cells9020509
- Cogné B, Bouameur JE, Hayot G, et al. A dominant vimentin variant causes a rare syndrome with premature aging. Eur J Hum Genet. 2020;28(9):1218-1230. doi:10.1038/s41431-020-0583-2
- Belbachir N, Portero V, Al Sayed ZR, et al. RRAD mutation causes electrical and cytoskeletal defects in cardiomyocytes derived from a familial case of Brugada syndrome. Eur Heart J. 2019;40(37):3081-3094. doi:10.1093/eurheartj/ehz308
- Kilens S, Meistermann D, Moreno D, et al. Parallel derivation of isogenic human primed and naive induced pluripotent stem cells. Nat Commun. 2018;9(1):360. Published 2018 Jan 24. doi:10.1038/s41467-017-02107-w

Coordonnées
Equipe

Reprogrammation / différenciation :
Caroline Chariau, 
technicienne
Margot Hallet, 
assistante ingénieure
Elsa Lemaitre,
assistante ingénieure
Isabelle Leray, 
assistante ingénieure
Yevgeniya Simon, 
technicienne
Edition du génome :
Sarah Tessier, ingénieure d'étude 
Rozenn Le Bloas, ingénieure d'étude 
Labels et certifications


Partenaires, Financeurs












